
04 Oct Miroir, miroir, dis moi quel est le plus bel embryon ?
Il était une fois, un ovule et un spermatozoïde …puis un microscope, un incubateur, une équipe de biologistes… et vous ! Vous, qui luttez pour ne pas harceler votre centre au téléphone et extirper des détails sur le développement (ou pas) de potentiels embryons à transférer. Et si on n’obtenait pas d’embryons ? Est-ce qu’ils seront beaux ? C’est quoi, un bel embryon d’ailleurs ? Est-ce qu’il vaut mieux avoir un J3, un J5 ou un J6 ? Y aura-t-il des embryons à congeler ?
C’est à toutes ces questions que répondent le Pr François VIALARD du département de génétique du CHI Poissy–Saint-Germain-en-Laye, le Dr. Lucie Chansel-Debordeaux, du Service de Biologie de la Reproduction-CECOS du CHU de Bordeaux et le Pr Marine POULAIN, responsable de l’Unité de Biologie de la Reproduction de l’hôpital Foch à Suresnes.
1, 2, 4, 8, 16… puis des centaines de cellules !
Commençons par le commencement (avec en prime un petit cours de biologie de la reproduction !). On parle d’embryon dès l’apparition de la première cellule faisant suite à la fusion entre l’ovocyte et le spermatozoïde. Cette cellule qui, chaque jour, va se diviser est capable de donner toutes les futures cellules du corps humain.
Au jour 1, on parle de zygote, une cellule unique avec deux pronoyaux, c’est-à-dire deux noyaux ou structures cellulaires, signe que la fécondation a bien eu lieu.
Puis, entre 20 et 25 heures plus tard, le zygote commence à se diviser en 2 cellules de taille égale, puis en 4, puis en 8 vers le 3e jour et en 16 au 4e jour.
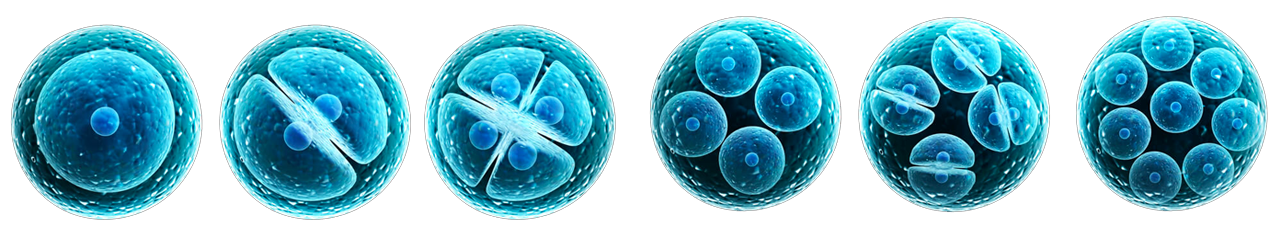
À partir de 16 cellules, l’embryon est appelé morula. C’est d’ailleurs entre le 3e et le 4e jour que les biologistes estiment que l’activation du génome paternel se fait ; ce qui signifie que l’ovocyte est seul responsable des premiers stades de division. On comprend ici pourquoi la qualité des ovocytes est déterminante !
Au stade de morula, on n’est plus en capacité d’observer les cellules individualisées qui se transforment en une masse compacte. Une cavité liquidienne se creuse au sein de l’embryon, embryon qui est alors appelé blastocyste à partir du 5e jour. À ce stade, l’embryon est formé de 2 types de cellules : les cellules de la périphérie (ou cellules du trophoblaste) qui donneront le placenta et les cellules de la masse cellulaire interne qui donneront le fœtus.
Ce sont ces stades de développement que les équipes de biologistes de votre centre vont venir observer et interpréter en vue d’un éventuel transfert.
Toi oui, toi non, toi au congel’ !
Au fil des années, les critères d’évaluation des embryons ont été unifiés. En réalité, le Pr Marine Poulain rassure « le biologiste n’évalue pas la viabilité d’un embryon en fonction de sa bonne ou mauvaise humeur. Il va donner un grade, une norme de priorité, en se basant sur une codification internationale ». Un embryon dit « non viable » est un embryon qui ne s’est pas divisé, ou dont la division s’est arrêtée, ou avec des cellules dégénératives. Il n’y a pas de devenir à cet embryon.
Ensuite, lorsque l’embryon est dit « viable », l’équipe de biologiste vient observer :
– la morphologie : le nombre de cellules, leur régularité, leur homogénéité et leur taux de fragmentation, l’aspect de la cellule ou de la membrane qui recouvre l’embryon.
– la cinétique, c’est-à-dire le rythme de la division et d’évolution de l’embryon jour par jour selon un référentiel. L’embryon a-t-il bien 8 cellules au 3e jour ? 16 au 4e ? , etc.
C’est à partir de cette description que les biologistes donnent un rang, c’est-à-dire un ordre de priorité pour le transfert. La classification, AA, BB, BB2, AC, est propre à chaque centre. Attention donc aux comparaisons si vous ne faites pas partie du même centre !
Les chiffres correspondent généralement au degré d’expansion des blastocystes, c’est-à-dire la taille de la cavité du blastocyste. Les lettres de A à C (D parfois) correspondent à l’observation de la masse cellulaire (est-ce qu’il y a beaucoup de cellules, et elle bien compacte, etc.) et du trophectoderme, c’est à dire de la couche externe du blastocyste (nombre et organisation des cellules du trophectoderme, tapis régulier, uniforme sur l’ensemble de la cavité).
Le choix de priorité va aussi se faire en fonction du contexte clinique, avec les équipes de médecins qui analysent l’âge, les antécédents, etc. Gardez bien en tête qu’à partir du moment où il y a un transfert, cela signifie que les équipes médicales pensent qu’il y a une chance de succès ! D’ailleurs, un embryon classé C ou D a statistiquement moins de chance de donner lieu à une grossesse, mais ce n’est pas impossible. Et surtout, s’il donne une grossesse, il n’y aura aucune différence sur l’évolution de cette grossesse ou la santé de l’enfant à naître !
Tous les embryons surnuméraires de bonne qualité, c’est-à-dire ceux qu’il reste après un transfert, seront congelés.
À noter !
Le Dr Lucie Chansel-Debordeaux rappelle que les données concernant vos tentatives ne sont pas nationales. C’est donc important de communiquer à votre équipe de soins le nom de votre précédent centre si vous en avez changé, pour que les biologistes se rapprochent d’eux afin d’obtenir des informations précieuses sur l’historique et mieux interpréter le choix de priorité dans le transfert.
J2, J3, J5 ou J6, frais ou congelé… Que le meilleur gagne !
Historiquement, la première grossesse par FIV provenait du transfert d’un blastocyste en 1978. Par la suite, cependant, la tendance était au transfert d’embryons au troisième jour, mais récemment le transfert d’embryons se fait de plus en plus au 5e jour.
Le dernier rapport de la Cochrane en mai 2022, un rapport qui reprend les études internationales randomisées et contrôlées, montre que les taux de grossesses cumulés – issus d’embryons frais et congelés-décongelés – par cycle sont les mêmes qu’il s’agisse d’un transfert précoce ou de blastocyste. Le Pr Marine Poulain reprend qu’ « il y a des avantages et des inconvénients pour les deux stratégies. »
Un transfert avec des blastocystes a de meilleurs taux de grossesse, mais moins d’embryons, car on les a laissés s’autosélectionner. À J2-J3, il y a moins de chances de grossesse par transfert, mais plus d’embryons, donc plus de transferts. Au final, une fois qu’on a utilisé tous les embryons dits « utiles » (transférables en frais ou congelé), on obtient le même taux de succès.
Le choix va aussi se faire en fonction de la patiente, du contexte et des antécédents, explique le Dr Lucie Chansel-Debordeaux.
Mêmes conclusions concernant les chances de succès des embryons transférés frais versus congelés. L’un ou l’autre n’est pas plus performant du moment que la technique de vitrification (processus de congélation utilisé aujourd’hui) est maîtrisée. Le Pr Marine Poulain note peut-être une différence si la patiente (et/ou son utérus) a besoin de repos après les stimulations ; dans ce cas un transfert d’embryon congelé sur le cycle suivant aura de meilleures chances de succès.

Comment ça marche la congélation ?
La technique de congélation consiste à exposer l’embryon à des bains successifs avec des cryoprotecteurs. On chasse les molécules d’eau des embryons pour éviter la formation de cristaux de glace qui feraient « éclater » les embryons. Ensuite on le plonge directement dans l’azote liquide et l’embryon passe de l’état liquide à l’état vitreux à -196 degrés. Pour la décongélation, on passe de l’azote liquide à un milieu à 37 degrés directement pour le décongeler et le laver des cryoprotecteurs. Le geste de décongélation prend généralement 10 à 15 minutes et les embryons sont décongelés plus ou moins deux heures avant le transfert.Mais alors, quelles sont les causes de mauvaise qualité des embryons ou de potentiel diminué ? Et est-ce qu’on peut agir ?
Le potentiel diminué d’un embryon peut être lié à plusieurs facteurs, mais, la plupart du temps, il s’agit d’une mauvaise qualité des gamètes dont dérive l’embryon. Navré mesdames, mais on parle surtout d’une mauvaise qualité des ovocytes, les 1res divisions se faisant grâce aux ressources énergétiques de l’ovocyte. Ici, l’âge est le facteur majoritaire de succès. Le Dr Lucie Chansel-Debordeaux explique qu’à partir de 35 ans, on observe une réelle dégradation de la qualité des ovocytes, mais attention le temps n’épargne pas non plus les hommes ! « Impossible de lutter contre le temps qui passe, mais sachez qu’il est possible de préserver ses ovocytes entre 29 et 36 ans. Sans que cela soit une garantie à 100% de succès, la préservation ovocytaire donne de réelles chances aux patientes de concevoir avec leurs ovocytes ! »
L’environnement, l’hygiène de vie et les modes de consommation viennent aussi impacter la qualité des gamètes des femmes ET des hommes. Le tabagisme actif est un des facteurs majeurs de mauvais développement embryonnaire, tout comme la mauvaise hygiène de vie générale. La bonne nouvelle, ici, c’est que ces atteintes de votre mode de vie sont réversibles ! En adoptant un mode de vie plus sain, vous pouvez améliorer la qualité de vos gamètes. Retrouvez plus de détails dans le dossier environnement du premier numéro de Paillettes.
La mauvaise qualité des embryons peut être aussi liée à de mauvaises conditions de culture en laboratoire, bien que cela soit de plus en plus rare, les centres étant accrédités et contrôlés.
Pour le Pr Marine Poulain, « le destin de l’embryon est scellé au moment de la rencontre des gamètes. À part mettre les conditions idéales pour impacter le moins possible de développement de l’embryon en biologie, ou optimiser les traitements de stimulation, on ne maitrise pas le reste. Surtout, il n’existe pas d’outil pour améliorer le potentiel d’implantation, seulement des outils pour mieux les sélectionner. Souvent les gens pensent que le time laps, l’ICSI, l’IMSI ou telle ou telle technique va améliorer la qualité des embryons. Mais nous sommes toujours dépendants de la qualité des gamètes ».
Et le futur, en termes de biologie et d’embryologie, c’est quoi ?
Les équipes de recherche se consacrent aujourd’hui à mieux comprendre le développement embryonnaire pour adapter les conditions de culture. Ce sont par exemple les travaux autour des embryons artificiels, créés à partir de cellules souches dont vous avez peut-être entendu parler. Ces derniers permettrons de comprendre l’impact des troubles génétiques sur les embryons et les causes biologiques des fausses couches à répétition. Il y a également des programmes de recherche pour essayer de réparer les erreurs génétiques présentes dans l’embryon.
L’innovation ensuite, se situe depuis de plusieurs années sur le développement d’outils pour améliorer la sélection des embryons. Le DPI-A par exemple, qui n’est pas aujourd’hui autorisé en France, permet de mieux évaluer la qualité des embryons et les chances d’implantation en détectant les anomalies aléatoires du nombre de chromosomes dans les cellules de l’embryon. Le time laps, déjà utilisé dans plusieurs centres, permet d’observer en continu les embryons sans les manipuler. L’association de tous ces outils avec l’intelligence artificielle permettrait d’obtenir des scores de prédiction plus performants pour mieux choisir l’embryon à transférer et obtenir une grossesse plus rapidement.
Et ça, ce n’est pas négligeable !


 CODES PROMO
CODES PROMO RECEVOIR LE MAG !
RECEVOIR LE MAG ! JE FAIS UN DON
JE FAIS UN DON 